시작하는 말
오가노이드(organoid)는 장기를 뜻하는 'organ'과 유사함을 뜻하는 접미사 'oid'가 합쳐진 용어이며, 미니장기 혹은 장기유사체라고도 한다. 인체 장기나 조직이 가지고 있는 다양한 세포 타입과 생체와 유사한 조직 구조, 그리고 각 장기의 특징적인 기능을 가진 3차원 세포 집합체로 그 특성을 설명할 수 있다.
자기조직화(self-organizing) 능력과 분화(pluripotency) 능력을 가진 전능한(totipotent) 줄기세포인 수정란(접합체, zygote)으로부터 인간의 장기가 만들어 지는 자연 발생과정(natural development)을 모방하는 분화 방법을 실험실에서 구현함으로써 오가노이드를 제작될 수 있다. 아직은 실제 인간의 장기와 동일한 크기로 만들기는 어렵지만, 인체를 구성하는 장기의 특성을 가지는 오가노이드를 배양접시 상에서 제작할 수 있다(그림1).
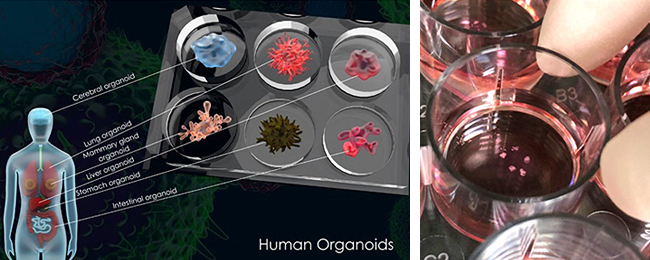
(우)실험실에서 배양한 장 오가노이드, 손미영 박사 실험실
오가노이드는 줄기세포의 분화 능력을 이용하여 만들 수 있는데 크게 두 가지 방법으로 만들 수 있다. 첫 번째는 성체줄기세포(adult stem cell; ASC)가 포함되어 있는 조직 생검(tissue biopsy)의 작은 조각을 세포 외 미세 환경을 모사할 수 있는 매트리겔(matrigel) 내에서 키우는 방법이다. 2009년 네덜란드의 한스 클레버스(Hans Clevers) 박사팀에서 최초로 인간 장 조직을 이용하여 장의 구조와 유사한 움-융모(crypt-villus) 구조를 가지는 3차원의 장 오가노이드를 보고하였다. 현재까지 성체줄기세포로부터 장, 간, 신장, 췌장, 위, 자궁, 고환, 유선 오가노이드 등이 제작 될 수 있다는 논문들이 발표되었다 (그림2). 두 번째 방법은 실험실에서 만든 전분화능줄기세포(puripotent stem cell)인 배아줄기세포(embryonic stem cell: ESC)와 환자의 분화된 체세포로부터 리프로그래밍(reprogramming) 기술에 의해 만들어진 유도만능줄기세포(induced puripotent stem cell: iPSC)를 이용하여 인간의 장기 발달과정을 실험실에서 모방하여 단계적으로 분화 시켜서 오가노이드를 만드는 방법이다. 마찬가지로 매트리겔 내에서 3차원적으로 배양할 수 있으며, 최근까지, 뇌, 망막, 갑상선, 장, 위, 간, 신장, 췌장, 유선, 자궁 오가노이드가 보고되었다(그림2).1)
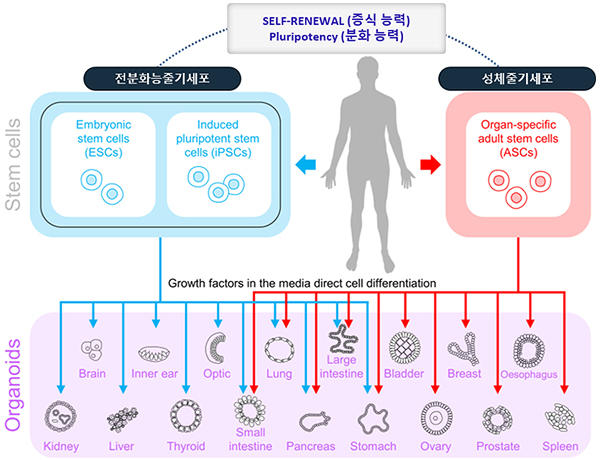
두 가지 방법은 각각 장단점을 가지는데, 성체줄기세포로부터 만들어진 오가노이드는 성체 조직을 이용하였기 때문에 기능성이 좀 더 높고, 비교적 짧은 시간 내에 확보가 가능하며, 환자의 유전적 정보를 가지고 있어 환자 맞춤형 모델로 활용이 가능하다. 하지만 이 방법은 조직 생검 확보가 필수적이기 때문에 정상 조직을 확보하기 어려운 뇌 조직의 경우에는 오가노이드를 제작하기에는 어려운 부분이 있다. 뿐만 아니라, 현재 기술로는 특정 장기 조직을 이용하여 해당 장기 오가노이드만을 제작할 수 있다. 반면 전분화능줄기세포 유래 오가노이드는 인체의 발달과정을 모방한 단계적 분화 기법(stepwise in vitro differentiation)을 통해 제작할 수 있으며, 대량생산이 가능하고, 재현성이 높다. 또한 환자 맞춤형의 전분화능줄기세포주(pluripotent stem cell line)를 확보할 수 있으므로 환자 맞춤형으로 다양한 장기에 대한 오가노이드를 각각 분화하여 만들 수 있다. 반면에 전분화능줄기세포로부터 만들어진 오가노이드는 비교적 긴 분화시간이 소요되며, 태아의 장기와 유사한 수준의 낮은 기능성을 가지고 있어 추가적으로 기능성을 획득할 수 있는 방법이 필요하다.
오가노이드, 어디에 활용할 수 있을까?
1. 질환 모델링
임상단계에 들어서야 실제 인체에서의 연구를 할 수 있기 때문에, 바이오 의학 분야의 기초 연구에서부터 신약개발 과정의 전임상 단계까지 실험 모델은 매우 중요하다. 기존 실험 모델로써는 효모(Saccharomyces cerevisiae), 예쁜꼬마선충(Caenorhabditis elegans), 초파리(Drosophila melanogaster)을 비롯하여, 척추동물인 zebrafish 모델, 생쥐 모델 등이 주로 모델 시스템으로 이용되어 왔고, 인간 세포 모델로써 암세포주 모델과 환자유래 종양이식 생쥐(patient-derived xenografts; PDX) 모델이 활용되고 있다.2) 목적하는 실험의 과학적 그리고 윤리적 관점까지 고려하여 모델 시스템을 선정하게 되다. 그렇지만, 인간과 동물 모델과의 종(species)간 차이를 극복하기 위해서는 결국 인간 세포 모델 혹은 인간 장기 모델을 통해 실험적인 검증을 하는 것이 중요하다. 전 세계의 연구자들이 실험실에서 구현한(in vitro) 인간의 장기와 가장 흡사한 생리학적 모델 시스템인 오가노이드를 실험 모델로 활용하는 이유이다.
오가노이드 모델은 세포 수준 및 모델 동물을 이용한 현재의 연구 패러다임을 바꿀 수 있는 잠재력을 가지며, 기초 연구, 신약 개발, 장기를 대체하거나 재생할 수 있는 치료법 개발 및 다양한 융합연구 분야에 적용이 가능하다. 우선, 줄기세포의 분화과정을 모니터링 하면서 인간 장기의 발달 과정에 대한 기전 연구가 가능하다. 특히, 전분화능줄기세포-유래 오가노이드는 인간의 발달 과정을 모방하여 분화 프로토콜을 만들게 되므로 인간 배아 발달 과정 모델링 할 수 있다.
또한, 오가노이드를 이용하여 인간의 다양한 질환에 대한 모델링이 가능하다는 결과들을 이미 전 세계의 연구자들이 발표하고 있다.3) 환자맞춤형 유도만능줄기세포가 주도한 줄기세포 연구의 획기적인 변화를 통해 이제는 연구자들이 건강한 사람과 질병에 걸린 환자 모두를 대상으로 무한대로 증식할 수 있는 인간 세포를 활용할 수 있게 되었다. 최근 각광받고 있는 CRISPR/Cas9 등의 유전자 편집 도구를 기반으로 한 유전자 교정 기술(gene-editing)을 이용하면 줄기세포 게놈을 정밀하게 조절할 수 있으며, 다양한 질환-특이적 유전자 변이를 도입할 수도 있다. 따라서 실험실에서 맞춤형 유전자 변형을 통해 다양한 인간의 질병 모델 세포 혹은 오가노이드를 생산하는 것이 가능하다.
2. 신약 개발
오가노이드는 신약개발에도 활용될 수 있는데, 질환 모델링뿐만 아니라, 유효물질 탐색(drug screening), 선도물질 발굴을 위한 유효성 및 독성평가(efficacy and toxicity test)에 이르는 신약개발의 전임상 모든 과정에서 활용이 가능하다. 즉, 실험실에서 실제 임상으로 이르는 과정인 중개의학(translational medicine)의 핵심적인 도구로 이용될 수 있다. 환자를 대상으로 하는 임상시험 전에 안전성과 유효성을 확보하기 위한 약의 용량과 체내 약물 농도의 관계를 연구하는 약동학(pharmacokinetics)과 약의 용량과 치료효과 및 이상반응, 즉 생리학적 작용기전을 확인하기 위한 약력학(pharmacodynamics) 분석이 필수적이다. 이러한 전임상 과정에서 보통은 실험동물을 이용하여 실험을 진행하게 되는데, 이때 많은 시간과 비용이 소요된다.
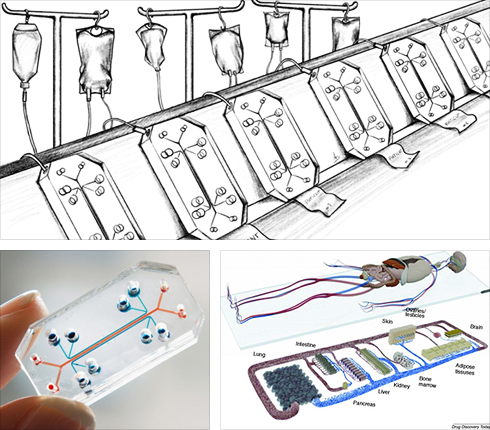
반면, 인체의 대체 장기 모델 시스템이자 환자 개인에게 개별화된 질병 오가노이드 모델은 인체의 실제 장기와 유사한 방식으로 약물에 반응할 수 있기 때문에, 신약개발에 있어 인체 세포 기반의 약물 유효성 평가가 가능하며, 정상 오가노이드를 이용한 약물의 독성 및 안정성 평가에도 활용이 가능하다. 즉, 인간과의 종간 차이로 인해 동물실험을 통해 확보된 전임상 데이터에 비해 인간 오가노이드를 이용하면 임상 예측률 향상에 도움을 줄 수 있어, 신약 개발 성공률이 증가할 것으로 기대된다. 세포 수준에서 효능이 있었던 약물이 전임상 과정에서 실험동물 모델을 통해 유효성 검증이나 독성을 검증하게 되는데, 결국 임상 단계에서 인간에 적용했을 때는 종간 차이에 의한 부작용이 발생할 수밖에 없는 가능성의 여지를 가지고 있는 것이다. 따라서 실제로 인간의 장기를 구성하는 다양한 세포 유형들이 상호작용하고 있는 현상을 반영할 수 있고, 인간 장기 특성을 초정밀 모사할 수 있는 오가노이드를 전임상에서 활용하는 전략을 통해 인체 기반의 연구를 실현하고, 임상예측률 향상과 신약개발 과정에서의 효율성을 강화할 수 있다.
구체적으로, 유도만능줄기세포 혹은 환자 조직을 이용한 환자맞춤형 오가노이드 모델은 생물학적 '아바타' 역할을 할 수 있다. 오가노이드가 인체의 장기와 비슷한 방식으로 약물에 반응할 수 있다면, 연구진은 환자를 불필요한 부작용에 노출시키지 않고도 약물의 효과를 보다 효율적으로 확인할 수 있게 된다. 이런 새로운 모델 시스템은 의료진이 환자가 특정 치료에 반응할지 여부를 보다 정확하게 예측할 수 있게 해줄 것이며, 특정 질병에 걸린 개별 환자의 세포 특성에 맞춘 치료법이 될 수 있을 것이다(그림3).4) 이처럼 오가노이드는 기초연구와 전임상 시험 모델 및 신약개발 플랫폼으로서 활용될 수 있고, 이러한 기대는 신약개발 및 제약 산업에서 완전히 새로운 가능성을 열어 줄 수 있다.
3. 재생 치료
손상된 조직이나 병변 부위의 재생을 위한 세포치료제는 윤리적인 문제와 안전성의 이슈로 인해 성체줄기세포를 중심으로 연구 및 허가가 이루어졌으나, 최근에는 유도만능줄기세포 기술을 통해 개인맞춤형 줄기세포치료제 개발이 함께 진행되고 있다. 특히 오가노이드는 높은 분화능을 가지고 있는 동시에, 재생능을 가지고 있는 줄기세포를 포함하고 있어 미래 재생치료제 기술로 주목받고 있다. 환자맞춤형 및 범용성 전분화능줄기세포를 활용한 다양한 오가노이드 기반 재생치료제 연구들이 전 세계 주요 연구자들을 주축으로 초기 단계이지만, 활발히 진행 중이다.5) 대량 증식이 가능한 오가노이드 기술을 이용하면 적은 양의 조직으로부터 이식을 위한 세포원을 보다 효율적으로 확보할 수 있다. 특히 유전자 교정기술을 통해 조직적합성항원(human leukocyte antigen, HLA)을 제거한 전분화능줄기세포로부터 오가노이드를 제작할 수 있어 면역거부반응으로부터 자유로운 범용성 오가노이드 생산이 가능하다. 실제로, 손상된 조직을 대체하기 위해 실험실에서 제작한 오가노이드를 대장, 소장, 간, 췌장 등에 이식 후에 기능성 회복 및 조직 재생에 있어 긍정적 효과가 보고되고 있다. 향후 바이오프린팅 기술과의 융합 연구를 통해 실제 인체 장기와 유사한 크기의 인공장기도 개발할 가능성이 있어, 학계와 산업계의 많은 관심을 받고 있다.
코로나19와 오가노이드
코로나19가 과학기술의 변화를 가속화하고 있는 현재, 오가노이드 기술 역시 빠르게 코로나19 치료제 개발에 활용되고 있다. 코로나19는 severe acute respiratory syndrome coronavirus-2(SARS-CoV-2)에 의한 호흡기 질환으로 국내 및 글로벌 제약사에서 백신과 치료제 개발을 진행 중이다. 다른 바이오 분야와 마찬가지로 코로나19의 실험 모델의 확보가 최우선 과제라고 할 수 있는데, 특히 바이러스 연구모델은 '숙주 특이성' 장벽을 극복할 수 있는 숙주 모델 개발이 중요하다. 일반적으로 사용되는 생쥐 모델에서는 코로나19의 스파이크 단백질의 결합이 어려워 모델로 사용하기에는 한계가 있고, 현재 영장류 모델이나 패럿 모델, 햄스터 모델, 혹은 인간 유전자를 도입한 형질전환 생쥐 모델이 활용되고 있다. 하지만 궁극적으로는 실제 인간 장기가 가지고 있는 구조와 세포 다양성을 확보하여 '숙주 특이성'을 극복하면서도, 종간 차이가 없는 인간 세포 모델 확보가 필요한데, 오가노이드가 그 대안이 될 수 있다.
코로나19 바이러스가 숙주세포를 감염시킬 때 스파이크 단백질이 숙주 세포 표면에 있는 '안지오텐신 전환효소 2(ACE2)' 수용체와의 결합이 우선적으로 일어난다. 캐나다의 Josef Penninger 연구팀은 ACE2와 유사한 재조합 단백질인 human recombinant soluble ACE2 (hrsACE2)를 실험실에서 합성하였고, 이를 코로나19 바이러스가 감염된 오가노이드에 처리하자 바이러스가 사라진다는 것을 확인하였다.6) hrsACE2 단백질이 코로나19 치료제로 개발된다면, 실제로 인간 오가노이드를 신약개발 과정에서 전임상 모델로 활용한 첫 사례가 될 것이다.
오가노이드 기술의 한계 극복
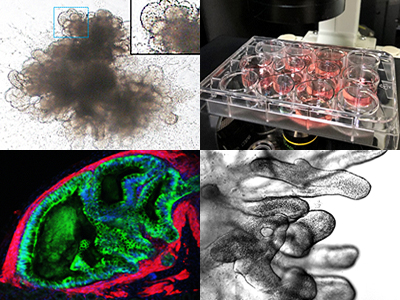
현재 오가노이드 기술로는 실제 장기의 복잡한 생물학적, 물리학적, 화학적 환경을 모두 반영하지 못하는 한계가 여전히 존재한다. 면역세포 및 혈관의 결핍이나 장기의 복잡한 구조를 모사하지 못한다는 한계가 있으며, 오가노이드의 적극적 활용을 위해서는 대량화, 대형화, 균질화, 그리고 재현성의 문제를 해결해야 한다. 또한, 인간의 장기와 유사한 수준의 기능성 오가노이드를 제작하기 위해서는 오가노이드의 낮은 기능성 문제를 해결해야 한다. 예를 들면, 2011년 미국 제임스 웰스 교수팀이 인간 전분화능줄기세포로부터 장 오가노이드를 만들었지만, 우리가 주로 연구해야 하는 성체의 장이 아닌 태아의 장처럼 미성숙하고 기능성이 매우 낮은 상태였다. 이러한 미완성의 장 오가노이드를 실제로 활용할 수 있는 인간 장기모델로 개발하기 위해서, 본 연구자가 책임자로 진행한 연구를 통해 인간의 장내 환경을 실험실에서 구현하는 '체외 성숙화(in vitro maturation)' 기술을 고안했고, 이를 통해 성인이 가지고 있는 생리학적 특성 및 기능성을 모두 가진 성숙한 장 오가노이드 모델을 개발하였다(그림4).7) 이는 줄기세포로부터 분화된 3차원 장 오가노이드가 가지는 기존의 미성숙 문제를 해결한 세계 최초의 성과로써 인체모사모델 기술의 수준을 높인 결과라고 할 수 있다.
'체외 성숙화' 기술을 통해 본 연구팀은 인간 장과 가장 유사한 오가노이드 모델을 개발하여 기존 오가노이드의 한계를 극복함으로써 보다 정확한 인체 반응을 예측할 수 있는 인체 장 모델을 개발하였다(그림 5).8) 이러한 오가노이드를 질환 모델로 개발하여 기초 연구나 환자를 대신할 수 있는 전임상 시험 모델로 활용될 수 있고, 장 오가노이드 자체를 인공장기나 재생치료제로 개발될 수 있는 확장성이 높은 기술로 이미 본 연구팀에서는 연구를 진행 중에 있다. 이외에도 마이크로바이옴 즉, 장내미생물을 연구하기 위한 플랫폼 개발을 비롯하여, 최근 가장 중요한 화두라고 할 수 있는 COVID-19 연구에도 본 연구팀의 기능성 인간 장 오가노이드 모델을 활용하고 있다.

(왼쪽 부터 연구책임자 손미영 박사, 권오만 박사, 정광보 연구원)
맺음말
OECD는 바이오기술과 다른 기술들과의 융합을 통해 2030년에는 바이오경제(bioeconomy)시대로 진입 할 것으로 전망하고 있다. 이에 따라 미래 핵심 바이오분야인 오가노이드 기술에 대한 각 요소 기술별 세계 최고 수준의 전문가가 필요한 실정이다. 오가노이드 분야의 연구자로써 과학 기술에 관심을 가지고 있는 이 글을 읽고 있는 학생들의 오가노이드 분야에 대한 관심과 지원을 기대 한다.
-
1) Kim, J., Koo, BK. & Knoblich, J.A. Human organoids: model systems for human biology and medicine. 2020 Nat Rev Mol Cell Biol. 21, 571–584. doi: 10.1038/s41580-020-0259-3.
-
2) Bredenoord AL, Clevers H, Knoblich JA. Science 2017 Jan 20;355 (6322):eaaf9414. doi: 10.1126/science.aaf9414.
-
3) M. Li, J.C. Izpisua Belmonte, Organoids - Preclinical Models of Human Disease. 2019 N Engl J Med 380(6): 569-579.
-
4) White Paper: Organoids – from stem cells to future technologies. 2020 Oct. Interdisciplinary Research Group Gene Technology Report of the BBAW & German Stem Cell Network (GSCN).
-
5) Takebe T, Wells JM, Helmrath MA, Zorn AM. Organoid Center Strategies for Accelerating Clinical Translation. Cell Stem Cell. 2018 Jun 1;22(6):806-809. doi: 10.1016/j.stem.2018.05.008.
-
6) Monteil V, Kwon H, Prado P, Hagelkrüys A, Wimmer RA, Stahl M, Leopoldi A, Garreta E, Hurtado Del Pozo C, Prosper F, Romero JP, Wirnsberger G, Zhang H, Slutsky AS, Conder R, Montserrat N, Mirazimi A, Penninger JM. Inhibition of SARS-CoV-2 Infections in Engineered Human Tissues Using Clinical-Grade Soluble Human ACE2. Cell. 2020 May 14;181(4):905-913.e7.
-
7) Jung KB, Lee H, Son YS, Lee MO, Kim YD, Oh SJ, Kwon O, Cho S, Cho HS, Kim DS, Oh JH, Zilbauer M, Min JK, Jung CR, Kim J, Son MY. Interleukin-2 induces the in vitro maturation of human pluripotent stem cell-derived intestinal organoids. Nat Commun. 2018 Aug 2;9(1):3039.
-
8) Kwon O, Jung KB, Lee KR, Son YS, Lee H, Kim JJ, Kim K, Lee S, Song YK, Jung J, Park K, Kim DS, Son MJ, Lee MO, Han TS, Cho HS, Oh SJ, Chung H, Kim SH, Chung KS, Kim J, Jung CR, Son MY. The development of a functional human small intestinal epithelium model for drug absorption. Sci Adv. 2021 Jun 2;7(23):eabh1586.